Introducción
En insectos, durante la cópula el macho transmite un eyaculado a la hembra. El cual está compuesto por esperma, y por fluido seminal que está compuesto por los productos de las glándulas accesorias, secreciones del conducto eyaculador, bulbo eyaculador y testículos. Estos productos provocan cambios en las hembras, como el aumento en la ovulación, de vuelo y alimentación, disminución en la receptividad de las hembras, activan reacciones antimicrobianas, en el almacenamiento de esperma y la oviposición (Ávila et al., 2011). En Anastrepha ludens (Loew) (Diptera: Tephritidae), la cópula incrementa el periodo refractario, estimula la oviposición e incrementa el número de huevos y cambia la respuesta olfativa de las hembras de responder a la feromona de los machos a los volátiles de hospedero (Abraham et al., 2014, Reyes-Hernández et al., 2021, Córdova- García et al., 2021). Sin embargo, los productos de las glándulas accesorias no incrementan la oviposición ni el desarrollo ovárico, tampoco inhiben la receptividad sexual de la hembra (Abraham et al., 2016, Reyes-Hernández et al., 2021, Córdova- García et al., 2021). El fluido seminal sin esperma no afecta la respuesta olfativa (Córdova- García et al., 2021). El estímulo mecánico de la cópula provoca que las hembras ovipositen más comparado con las hembras no apareadas (Reyes-Hernández et al., 2021). Por último, las proteínas del fluido seminal podrían tener funciones en la ovogénesis (Córdova-García et al., 2022). Todavía es incipiente nuestro entendimiento del fluido seminal y los productos de las glándulas accesorias en el comportamiento poscopulatorio de A. ludens. El fluido seminal puede afectar la producción de huevos y, por lo tanto, la inversión maternal. Después de la cópula, la hembra invierte recursos (tiempo y energía) para buscar el hospedero indicado y ovipositar para el buen desarrollo de su progenie (Aluja et al., 2000). Después de la oviposición, algunas especies del género Anastrepha, marcan el hospedero con la feromona de marcaje de hospedero (FMH) para indicar que el recurso ha sido ocupado (Silva et al., 2012). En A. ludens se sabe que la feromona de marcaje la coloca después de la oviposición, para reducir la competencia de la misma o de diferentes especies en el hospedero, ya que representa una fuente de recursos limitados (Prokopy et al., 1978, Díaz-Fleischer et al., 2000, Aluja et al., 2009a), estimula el marcado continuo del hospedero, pero por la adaptación sensorial de la hembra a la FMH puede limitar la acción disuasoria de oviposición al existir una saturación en el hospedero (Papaj y Aluja, 1993). Por otro parte, puede servir como una señal para los enemigos naturales, que logran identificar la presencia de la FMH para ubicar a sus hospederos (Hoffmeister y Roitberg, 2008). Nuestro entendimiento de qué factores estimulan o afectan este comportamiento de marcaje es todavía incipiente. Por ejemplo, se desconoce si las hembras no apareadas producen FMH, o cómo la cópula, la calidad del macho y el fluido seminal afectan la inversión maternal (número de huevos puestos y tiempo de marcaje) a través de la FMH, en este trabajo se estudiaron estos factores. El comportamiento de marcaje de hospedero es importante comprenderlo en especies de importancia económica, como es el caso de A. ludens debido que ocasiona pérdidas económicas importantes para el sector frutícola (Zapata, 2022). En México principalmente infesta mango, zapote blanco, algunos cítricos como la naranja, toronja, pomelo chino y naranjillo, ocasionalmente puede infestar durazno y guayaba (Hernández-Ortiz, 2007). El uso de la FMH se puede incorporar a otros métodos de control como la técnica del insecto estéril (TIE) o en el control biológico.
Antecedentes
Anastrepha ludens
Es una especie holometábola (metamorfosis completa), tiene una etapa de huevo, larva (3 estadios larvales), pupa y adulto (Hernández-Ortiz, 2007). Las hembras ovipositan los frutos y las larvas se desarrollan en el interior, alimentándose de la pulpa, cuando el fruto está maduro cae al suelo, las larvas salen y pupan en el suelo, después de cierto tiempo emerge el adulto (Aluja, 1993).
Cópula
La cópula o apareamiento se basa en una serie de comportamientos donde mucho influye el esfuerzo del macho por cortejar a la hembra y la receptividad de esta al aceptar al macho y reproducirse, pero interfieren una serie de factores como el ambiente, la condición del macho y de las hembras (Baena-Hurtado y Pérez-Staples, 2015, Arredondo et al., 2020). Durante la cópula el macho transfiere fluido seminal, que induce cambios fisiológicos y conductuales poscópula en las hembras. Las moscas del género Anastrepha emplean una estrategia de apareamiento llamada lek, que consiste en la agrupación de machos y defensa de sitios, especialmente en las hojas de los árboles donde emiten feromonas, extienden sus alas y las agitan para atraer a las hembras, a esto se le conoce como llamado. En esta especie A. ludens, los machos llaman durante el crepúsculo y la duración de la cópula dura en promedio 73 minutos (Aluja et al., 2009b), aunque puede variar entre los 58.5 y 78.4 minutos, dependiendo de la edad del macho y su experiencia sexual (Pérez-Staples et al., 2010). Además, la cópula induce el periodo refractario sexual, estimula la oviposición e incrementa el número de huevos, cambia la respuesta olfativa de las hembras de responder a la feromona de los machos, a los volátiles de hospedero (Abraham et al., 2014, Córdova-García et al., 2021, Reyes-Hernández et al., 2021). Después de la cópula las hembras ovipositan en los frutos y marcan el hospedero. Durante los procesos poscopulatorios las hembras pueden llevar a cabo la elección criptica femenina, que puede consistir en: sesgar la paternidad hacia un macho (al expulsar el esperma de manera selectiva), evitar su intromisión completa, reaparearse con otro, no ovular o invertir menos en su progenie, todos estos mecanismos permiten que las hembras puedan tener control en su reproducción (Baena-Hurtado y Pérez-Staples, 2015). Otro mecanismo de sesgo en la paternidad es invertir o no invertir en la progenie dependiendo del macho (Wedell y Karlsson, 2003). El comportamiento de marcaje de hospedero puede ser un tipo de inversión maternal en el cual la hembra podría manipular este comportamiento para sesgar la paternidad.
Fluido seminal
El fluido seminal de los insectos está compuesto por espermatozoides, por los productos de las glándulas accesorias (PGAs) y por secreciones del conducto eyaculador, bulbo eyaculador y testículos. Es importante porque causa modificaciones en el comportamiento y fisiología de las hembras después de ser transferido, impactando el sistema nervioso, además de que se ha descubierto que incrementan la oviposición, aumentan el periodo refractario, la alimentación y la ovulación (Ávila et al., 2011). Los PGAs están formados por diversas proteínas, pero también por lípidos, carbohidratos y agua (Gillot, 2003). En Drosophila melanogaster (Meigen), proteínas como la ovulina Acp26Aa, estimula la oviposición, la glicoproteína Acp36DE provoca cambios en la conformación uterina de la hembra y que favorece el almacenamiento del esperma, el Acp62F inhibidor de proteasa tiene un funcionamiento similar a la Acp36DE (Wolfner, 2002). En A. ludens los productos de las glándulas accesorias no incrementan la oviposición ni el desarrollo ovárico, tampoco inhiben la receptividad de la hembra (Abraham et al., 2014, 2016, Reyes-Hernández et al., 2021). El fluido seminal sin esperma no afecta la respuesta olfativa, pero las proteínas del fluido seminal podrían estar desempeñando funciones en la ovogénesis, respuesta inmune, longevidad, memoria olfativa y formación de memoria (Córdova-García et al., 2022). La calidad del fluido seminal y la receptividad de la hembra depende de la condición del macho (Aluja et al. 2009b, Abraham et al., 2016).
Oviposición
El comportamiento de la oviposición es uno de los aspectos más estudiados en moscas de la fruta, el cual comienza con la búsqueda o forrajeo por parte de la hembra, donde despliega conductas sobre el fruto con el fin de encontrar el sustrato más adecuado para depositar sus huevos, el cual permitirá el desarrollo de los estadios larvales (Aluja, 1993). Anastrepha ludens pone de 1 a 40 huevos por puesta, esto lo hace insertando el ovipositor en el fruto hospedero, el tamaño de la puesta puede variar dependiendo de la calidad del fruto y de la competencia en este por parte de otras hembras. Es una especie que está limitada por el tiempo, es decir tienen una gran cantidad de huevos, pero muy poco tiempo para depositarlos por la rápida maduración de sus hospederos (Díaz-Fleisher y Aluja, 2003), ya que el grado de madurez y el tipo de fruto son factores que limitan la oviposición. Por lo que las hembras depositan más huevos en frutos inmaduros, con firmeza y que no tengan presencia de azúcar, comparado con frutos blandos y maduros. También las hembras prefieren hospederos grandes ((Díaz-Fleischer & Aluja, 2003), (Birke Biewendt, 2006).
Feromona de marcaje de hospedero
La Feromona de Marcaje de Hospedero (FMH) son señales químicas disuasorias producidas por las hembras, con la finalidad de evitar que otras hembras de la misma o diferente especie ovipositen, ya que el fruto representa una fuente de recursos limitados. Además, evita la competencia entre las larvas y asegura la progenie, ya que emite una señal intra e interespecífica que conlleva información sobre el tiempo transcurrido desde la oviposición, la calidad del recurso y el nivel de competencia a la que está sometida la progenie (Diaz-Fleischer et al., 2000). Aunque la principal función es reducir la competencia en un mismo fruto, inhibir el comportamiento de oviposición, provoca que la hembra reduzca o aumente el número de huevos por puesta (Papaj y Aluja, 1993). La FMH se ha estudiado en especies como en Rhagoletis cerasi (Linnaeus), las moscas expuestas a FMH pasaron menos tiempo en los árboles, volaron más y depositaron menos huevos en la fruta, comparadas con las moscas que no se expusieron. Las hembras que estuvieron expuestas continuamente a un ambiente saturado de FMH tuvieron mayor tendencia por ovipositar en frutos marcados (Aluja y Boller, 1992). De igual manera, se realizó otro trabajo donde una parte de los hospederos se marcó con FMH y se redujo la infestación (Aluja y Boller, 1992). En Rhagoletis pomonella (Walsh) las hembras mostraron una tendencia mayor a ovipositar en frutos marcados con FMH, conforme pasaba el tiempo de la oviposición anterior (Roitberg y Prokopy, 1983). En Ceratitis capitata (Wiedemann) las FMH inhibieron la oviposición, esta conducta se presentó con mayor frecuencia en frutos sanos marcados comparados con los frutos que tenían marcas anteriores de oviposición y presencia de FMH (Papaj et al., 1992). La FMH también El comportamiento de marcaje se ha reportado en diez especies del género Anastrepha entre las cuales se encuentran A. ludens, A. obliqua, A. fraterculus (Wiedemann) y A. serpentina que liberan FMH en la superficie del área de oviposición (Papaj y Aluja, 1993, Silva et al., 2012). Las hembras de A. ludens realizan el marcaje mediante el arrastre del acúleo, donde esparcen la feromona después de la oviposición. La FMH estimula el comportamiento continuo del marcado después de la puesta de huevos, y se regula por la adaptación sensorial o habituación de la FMH, es decir, si hay saturación de FMH, no inhibe la oviposición, pero el marcado disminuye progresivamente según los episodios que se presentan (Papaj y Aluja, 1993). En A. ludens, A. obliqua y A. serpentina cuando el hospedero está marcado con FMH, reducen el tiempo de residencia en el árbol, el tiempo dedicado al hospedero y el número de intentos de oviposición (Aluja y Diaz-Fleischer, 2006), lo mismo sucede con A. fraterculus y C. capitata (Magalhães et al., 2022). Los productos de FMH sintéticos han mostrado eficiencia similar al FMH natural y además que existe reconocimiento cruzado de FMH entre diferentes especies (Aluja et al., 2009a, Magalhães et al., 2022).
Técnica del insecto estéril (TIE) La TIE es una técnica que busca reducir la natalidad de insectos plaga, al producir individuos esterilizados mediante rayos X o rayos gamma de manera masiva, para ser liberados en campo. Los machos irradiados compiten con los machos silvestres por las hembras y que estas no puedan tener progenie, y así disminuir la población de la especie (Liedo et al., 2009), su fertilidad es del 1% (Allinghi et al., 2007) aunque el promedio de vida de los machos irradiados es relativamente corto. Por ejemplo, la cepa Tapachula-7 de A. ludens, vive aproximadamente de 4 a 5 días en campo (Flores et al., 2015). La TIE también depende de la capacidad de los machos en transmitir un eyaculado e inhibir el reapareamiento de las hembras (Abraham et al., 2016),. Llas hembras que copulan con machos irradiados almacenan menos esperma, en comparación con las que copulan con machos silvestres, lo cual podría impactar en que las hembras silvestres se reapareen (Contreras-Navarro et al., 2020). En otro estudio se demostró que las hembras silvestres tienen periodos refractarios más cortos cuando se aparean con machos irradiados vírgenes (de la cepa Tapachula-7) comparadas con las que se aparean con machos con experiencia sexual (Arredondo et al., 2017). En cuanto a la competitividad sexual los machos silvestres de A. ludens reducen su actividad en ambientes de laboratorio, a diferencia de los machos irradiados que tienen actividad sexual tanto en laboratorio como en campo, y hay diferencias en el comportamiento de llamado, los machos irradiados llamaron más temprano y por mayor tiempo, que los silvestres en ambos ambientes (Meza y Diaz-Fleischer, 2006). En la etapa precopulatoria existen factores que afectan el fracaso del apareamiento de las hembras con los machos estériles, como las diferencias entre machos estériles y silvestres en términos de éxito en el cortejo del macho, producción y dispersión de feromonas y la discriminación de las hembras (Pérez-Staples et al., 2013). En la etapa poscopulatoria los factores que intervienen en el fracaso reproductivo de la hembra son la transferencia del eyaculado, pero desconocemos que efecto tiene una cópula con un macho irradiado en el comportamiento de marcaje de la hembra. Es decir, en estudios previos se ha demostrado que las hembras no apareadas o las que se aparean, pero no reciben un eyaculado también ovipositan (Reyes-Hernández et al. 2021) y sabemos que un macho estéril transmitirá poco esperma, pero que las hembras de todas maneras ovipositarán (Contreras-Navarro et al., 2020, Reynolds et al., 2022), pero ¿las hembras igual marcarán el hospedero? La TIE y cualquier método de control requiere un amplio conocimiento sobre la biología de la especie, del comportamiento, la dinámica poblacional y principalmente del proceso reproductivo.
Justificación
Anastrepha ludens, comúnmente conocida como la mosca mexicana de la fruta, es una plaga de alta importancia económica en México, ya que infesta diversos frutos comerciales como mango, cítricos y zapote blanco, causando pérdidas significativas al sector agrícola. Comprender su biología y comportamiento reproductivo es clave para mejorar las estrategias de manejo integrado de plagas, particularmente aquellas que involucran la Técnica del Insecto Estéril (TIE), ampliamente usada para el control poblacional de esta especie.
Uno de los comportamientos menos comprendidos pero de gran importancia ecológica es el marcaje de hospedero mediante feromonas, una estrategia que las hembras utilizan para señalar los frutos ovipositados, evitando la competencia larval entre crías. Aunque se sabe que este comportamiento está ligado a la oviposición, se desconoce con claridad si el apareamiento, el tipo de cópula, la calidad del eyaculado o la condición fisiológica del macho influyen en la expresión de este comportamiento.
Estudios previos han demostrado que hembras vírgenes pueden ovipositar, y que incluso sin recibir esperma, algunas hembras responden conductualmente al estímulo mecánico del apareamiento. Sin embargo, la relación entre estos factores y la producción o intensidad del marcaje de hospedero permanece poco explorada, lo cual limita la comprensión del potencial reproductivo real de las hembras bajo condiciones controladas o en campo, y por tanto, reduce la efectividad de herramientas como la TIE si no se consideran estos aspectos en su aplicación.
Este estudio busca llenar ese vacío de conocimiento al evaluar de manera sistemática el efecto del apareamiento, del fluido seminal y de la calidad del macho sobre la inversión maternal, expresada en términos del número de huevos ovipositados y del tiempo de marcaje. Estos indicadores permitirán inferir hasta qué punto la hembra regula su inversión reproductiva en función de señales recibidas durante la cópula, lo cual tiene implicaciones directas en el desarrollo de técnicas de control biológico más eficaces, que consideren no solo la esterilidad de los machos liberados, sino también su capacidad de inducir respuestas reproductivas adecuadas en las hembras.
En suma, este trabajo se justifica tanto por su relevancia básica, al contribuir al entendimiento de la biología reproductiva de A. ludens, como por su aplicación práctica, al generar conocimiento útil para optimizar programas de manejo integrado de plagas y evitar reinfestaciones en cultivos de alto valor comercial.
Pregunta de investigación
¿De qué manera influye la condición del macho y el tipo de cópula (eyaculado completo, fluido seminal sin esperma o solo estimulación mecánica) en la inversión maternal de Anastrepha ludens, evaluada a través de la oviposición y el comportamiento de marcaje de hospedero?
Hipótesis
Las hembras de Anastrepha ludens que copulan con machos fértiles que transfieren un eyaculado completo invertirán más en su progenie (pondrán más huevos y marcarán por más tiempo el hospedero) que aquellas que copulan con machos estériles, reciben solo fluido seminal sin esperma o únicamente estimulación mecánica.
Objetivos
1) Evaluar cómo la cópula y el fluido seminal sin esperma afectan la inversión maternal a través del comportamiento de marcaje de la FMH.
2) Estimar si la condición del macho afecta la inversión maternal a través del comportamiento de marcaje de la FMH.
Metodología
Obtención de A. ludens silvestre y de laboratorio
Se colectó naranja agria (Citrus auratium L.) para obtener A. ludens silvestre. Las colectas se realizaron en Cocoxatla, Coatepec y en La Estanzuela, Municipio de Xico, Coatepec y Emiliano Zapata, Veracruz, México, respectivamente. La fruta se colocó en bandejas tapadas con tela y se procesó en el Instituto de Biotecnología y Ecología Aplicada (INBIOTECA), donde se llevaron a cabo los experimentos (figura 1). La fruta se revisó constantemente para la obtención de larvas (figura 2) y se depositaron en vasos con sustrato (vermiculita), estos fueron etiquetados indicando el número de larvas y la fecha de colecta. A partir de la fase de pupa pasaron ± 20 días para que emergieran las moscas.

Adicionalmente se obtuvieron moscas de la cepa bisexual (irradiadas). Este material fue enviado en estado de pupa desde la Planta Moscafrut, ubicada en Metapa De Domínguez, Chiapas, México. Las moscas emergieron en ± 5 días a partir de que llegaron al laboratorio de INBIOTECA.
Tanto para moscas silvestres como de laboratorio, los adultos se colocaron en jaulas de 30 x 30 x 30 cm., armadas con marcos de madera cubiertos por tela tul y una media. Se alimentaron con agua y proteína hidrolizada en proporción 3:1 (azúcar: proteína) y se sexaron a los 2 días después de la emergencia.
Microcirugías
Para obtener machos de distifalo cortado y sin testículos se siguió la metodología de Córdova-García et al., (2021) y Abraham et al., (2016). Brevemente, se colocaron los individuos dentro de un tubo Eppendorf en hielo por aproximadamente 3 minutos para anestesiarlos. Para obtener individuos que pudieran copular, pero no transmitir un eyaculado, se cortó la parte final del adéfago (figura 3). Para obtener individuos que transmitiera solo fluido seminal se extrajeron los testículos (figura 4) con un alfiler entomológico (Ento Sphinx 0.20 mm de diámetro). Se cortó el vaso deferente de cada uno de ellos bajo un microscopio (Olympus, SZX7 zoom, Japón).
.jpg)
Observación de cópulas
Las moscas se colocaron en jaulas de 15 x 15 x 15 cm (una para cada tratamiento) en una proporción 1:1. Las observaciones se llevaron a cabo a partir de las 16:00 pm a las 20:00 pm para las silvestres y de 14:30 pm a 18:30 pm para las irradiadas. Cuando la cópula se formó, la pareja se mantuvo en un frasco hasta que se separaron. Las hembras apareadas se colocaron en otras jaulas separadas por tratamiento y los machos se desecharon. Las hembras apareadas se usaron al siguiente día para evaluar el comportamiento de marcaje. Los experimentos se realizaron en el laboratorio con una temperatura 25°C ±1° y 60 ± 10% humedad relativa.
Efecto del fluido seminal en el comportamiento de marcaje
Se utilizaron moscas silvestres de 15 a 25 días de edad. Se utilizaron los siguientes tratamientos: hembras apareadas con machos de distifalo cortado (solo recibían estímulo mecánico de la cópula sin eyaculado), hembras apareadas con machos sin testículos (recibían solo fluido seminal no esperma), hembras apareadas con machos intactos (recibían eyaculado completo) y hembras vírgenes. Este experimento se realizó para saber cómo afectan los diferentes estímulos que recibe la hembra durante el apareamiento en la inversión maternal a través del comportamiento de marcaje de la FMH. Se realizaron 17 réplicas.
Efecto de la condición del macho en el comportamiento de marcaje
En el segundo experimento se usaron adultos de 15 a 20 días y de 10 a 15 días de edad para silvestres e irradiados, respectivamente. Los tratamientos fueron: hembras que copularon con machos silvestres o irradiados. En este experimento se determinó si la condición del macho afecta la inversión maternal a través del comportamiento de marcaje de la FMH. Se realizaron 16 réplicas.
Comportamiento de marcaje
Se utilizaron 3 hembras por tratamiento, marcadas en el tórax con un punto de pintura politec con colores diferentes. Posteriormente las 3 hembras se colocaron en un vaso con una esfera de agar envuelta en Parafilm como unidad de oviposición (Figura 6). Se grabó el comportamiento de las hembras de 9:00 am a 17:00 pm con una video cámara (SONY HDR-PJ790V, Japón).
Posteriormente se analizó la latencia a la oviposición (tiempo desde que se inició a grabar hasta cuando comienza la primera hembra a ovipositar) y las conductas de oviposición y de marcaje de hospedero. Se consideró la conducta de la primera hembra en la conducta a la latencia a la oviposición (se refiere al tiempo que transcurrió en el video para comenzar a ovipositar), oviposición, si marcó o no, el tiempo de marcaje y en cuanto al número de huevos se tomó el promedio. El comienzo de oviposición se consideró a partir que la hembra introdujo su ovipositor en la esfera de agar y concluyó cuando la hembra lo sacó. La conduta de marcaje de hospedero se determinó a partir del arrastre del acúleo hasta levantarlo. Se analizó en cada video si había oviposición por parte de alguna de las tres hembras.
.jpg)
Conteo de huevos
Se contabilizó el número de huevos en cada esfera de agar un día después de las grabaciones. Se fue rebanando la esfera en partes para ir revisando cuidadosamente si había huevos individuales o en paquetes, de igual manera se contaron los huevos en los vasos. Esto se llevó a cabo en ambos experimentos.
Análisis estadísticos
Efecto del fluido seminal en el comportamiento de marcaje
Para determinar la probabilidad de oviposición y de marcaje se utilizaron tablas de contingencia (Si/No). La latencia a la oviposición se analizó con una Kruskal-Wallis. Para analizar el tiempo de marcaje se realizó un GLM con una distribución Gaussian y una función link Identity. El número de huevos se analizó mediante un GLMA con distribución Poisson con función link log.
Efecto de la condición del macho en el comportamiento de marcaje
Para determinar si había diferencias entre los dos tratamientos en la latencia a la oviposición y entre el número de huevos se realizó una prueba t de Student para muestras independientes. La probabilidad de marcaje (Si/No) se analizó con una tabla de contingencia y el tiempo de marcaje con una Mann Whitney U. Todos los análisis se llevaron a cabo en el software Jamovi versión 1.8.
Resultados
Efecto del fluido seminal en el comportamiento de marcaje
No hubo diferencias significativas entre los tratamientos en la latencia a la oviposición (χ2 = 4.35, gl = 3, P = 0.226, N = 62) (figura 6).
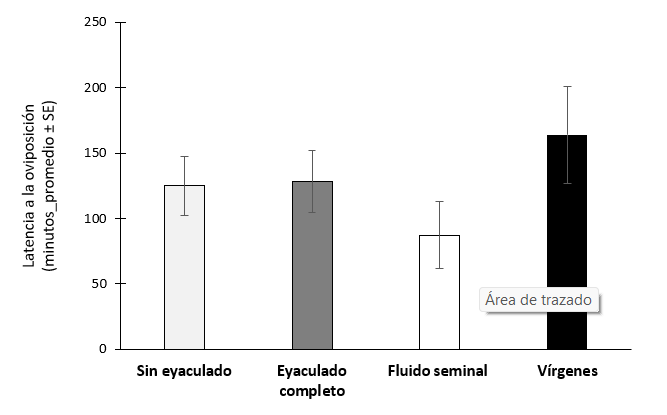
Figura 6.- Latencia a la oviposición de hembras de Anastrepha ludens después de recibir o no recibir un eyaculado.
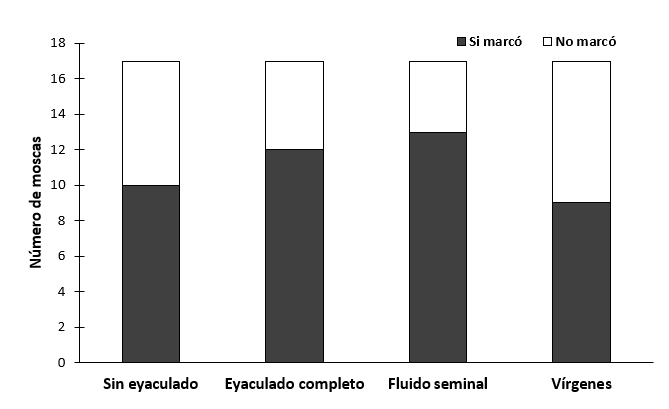
Para la probabilidad de que las hembras ovipositen no hubo diferencias entre las hembras de los distintos tratamientos (χ2 = 1.41, gl = 3, P= 0.704, N =68) (figura 7)
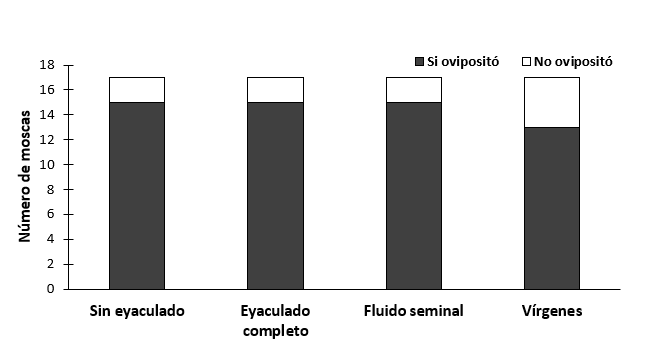
Figura 7.- Probabilidad de oviposición de hembras de Anastrepha ludens después de recibir o no recibir un eyaculado.
Las hembras que recibieron el fluido seminal, un eyaculado completo y las que no recibieron un eyaculado ovipositarón más huevos a comparación de las hembras vírgenes (tratamiento: χ2 = 56.8, gl = 3, P = <.001), (réplica: χ2 = 33.4, gl= 1, P = <.001). Las pruebas posthoc revelaron que las hembras que recibieron fluido seminal (es decir PGAs más no sin esperma) ovipositarón más huevos que las que no recibieron un eyaculado (vírgenes o hembras que copularon con machos con distifalo cortado, pero no recibieron un eyaculado) (Z= -3.20, P= 0.008), pero no hubo diferencias significativas con las hembras que recibieron el eyaculado completo (Z= -1.49, P= 0.810) (figura 8).
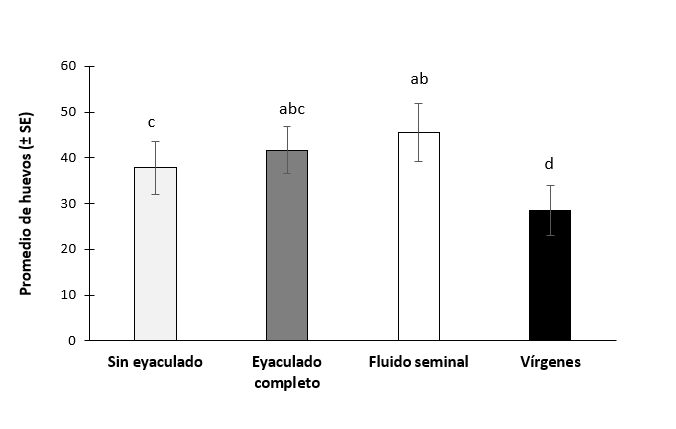
Figura 8.- Promedio de huevo puestos por hembras de Anastrepha ludens después de recibir o no recibir un eyaculado.
En la probabilidad de marcaje de hospedero no se encontraron diferencias significativas entre los tratamientos (χ2 = 2.58, gl = 3, P = 0.462, N =68) (figura 9), ni en el tiempo de marcaje de los tratamientos (χ2 = 3.40, gl =3, P = 0.334, N = 44) (figura 10).
Figura 9.- Probabilidad de marcaje de hospedero de hembras de Anastrepha ludens después de recibir o no recibir un eyaculado.
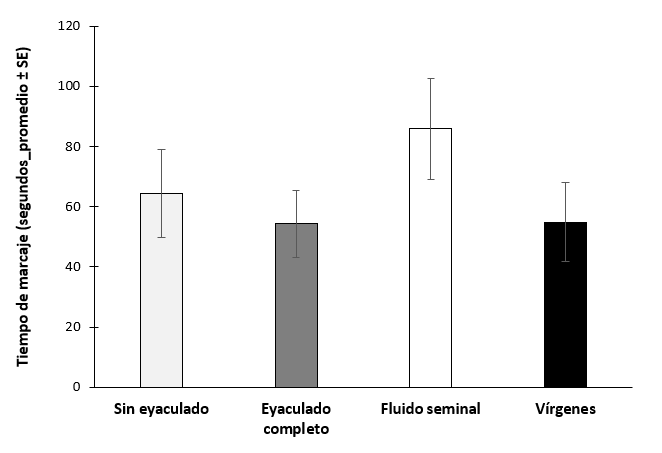
Figura 10.- Tiempo de marcaje de hospedero de hembras de Anastrepha ludens después de recibir o no recibir un eyaculado
Efecto de la condición del macho en el comportamiento de marcaje
No hubo diferencias en la latencia a la oviposición entre las hembras que copularon con machos irradiados o silvestres (t= -0.0547, gl= 30, P=0.957, N=32) (figura 11). El 100% de hembras ovipositaron en ambos tratamientos. Tampoco hubo diferencias en el número de huevos ovipositados (t=0.262, gl= 30, P=0.795, N=32) (figura 12), o en la probabilidad de marcaje de hospedero (χ2 =0.821, gl= 1, P = 0.365, N = 32) (figura 13).
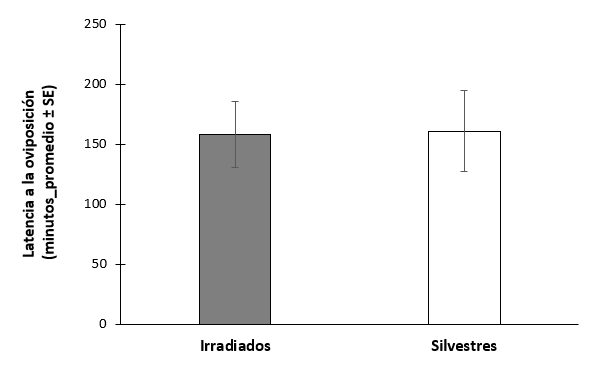
Figura 11.- Latencia a la oviposición de hembras Anastrepha ludens copuladas con machos irradiados de la cepa bisexual y machos silvestres.
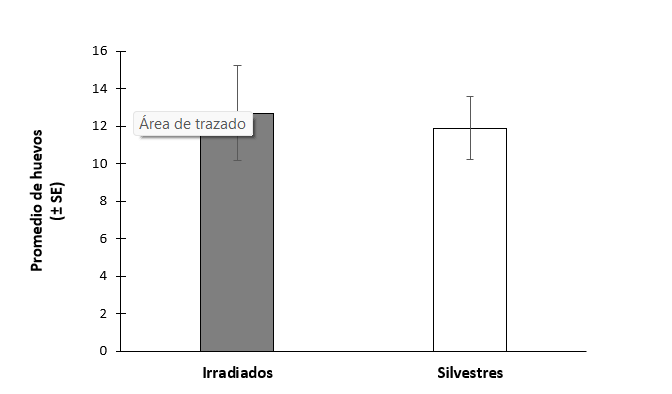
Figura 12.- Promedio de huevos de hembras Anastrepha ludens copuladas con machos irradiados de la cepa bisexual y machos silvestres.
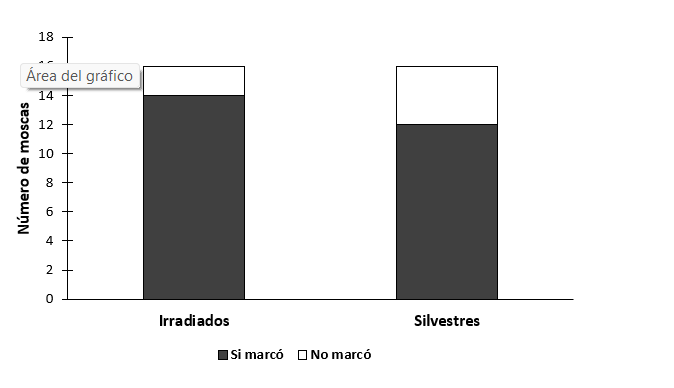
Figura 13.- Probabilidad de marcaje de hembras Anastrepha ludens copuladas con macho silvestre o irradiado cepa bisexual.
Aunque si hubo diferencias en las hembras que copularon con machos silvestres tardaron más tiempo marcando en comparación que las que copularon con machos irradiados (Mann Whitney U = 6.00, P = <.001, n1 =12, n2 =14) (figura 11).
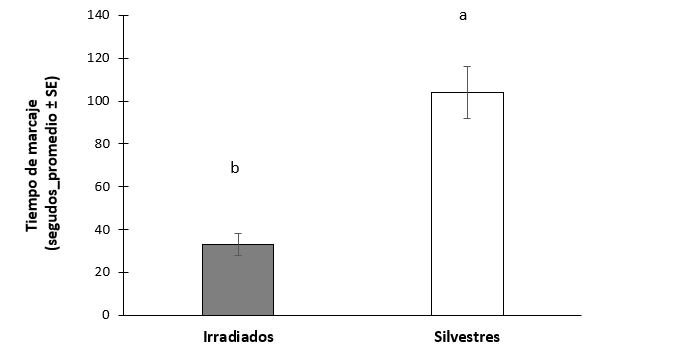
Figura 14.- Tiempo de marcaje de hospedero por hembras Anastrepha ludens copuladas con machos irradiados de la cepa bisexual y machos silvestres.
Discusión
Las hembras invierten en su progenie a través de búsqueda de sitios adecuados para la oviposición, cuidado de las crías o inclusive a través de la FMH que puede reducir la competencia alimentaria entre las crías de otras hembras. En este trabajo estudiamos cómo el estado fisiológico de la hembra, el fluido seminal y la condición del macho influyó en la inversión maternal a través de la oviposición y el tiempo invertido en depositar la FMH. Encontramos que el estado fisiológico de la hembra influyó en la oviposición, pero no en el comportamiento de marcaje, contrario a lo que ocurrió con la condición del macho, la cual afectó el comportamiento de marcaje y no el de oviposición. Las hembras que recibieron un eyaculado completo o fluido seminal (sin esperma) tuvieron un mayor promedio de huevos, en comparación con las hembras vírgenes y las que no recibieron eyaculado, esto indica que el eyaculado completo es necesario para inducir mayor oviposición. Sin embargo, las hembras vírgenes o que reciben un estímulo mecánico sin eyaculado sí hacen una inversión maternal en la puesta de huevos a pesar de no recibir espermatozoides o fluido seminal. No se observó un efecto del fluido seminal (productos de las glándulas accesorias, más productos del ducto eyaculador o bulbo eyaculador) en el tiempo invertido en el marcaje, esto indica que debemos seguir estudiando la función de estas biomoléculas.
Encontramos que el estímulo mecánico por sí solo aumenta la puesta de huevos comparado con las hembras vírgenes lo cual concuerda con lo reportado por Reyes-Hernández et al. (2021). Sin embargo, a diferencia de ese estudio, encontramos que el fluido seminal sin esperma sí incrementa el número de huevos en comparación con las vírgenes y con las que solo reciben estimulo mecánico. Esta diferencia tal vez se deba a que, en este estudio, se utilizó el método de testectomía de machos de tal manera que las hembras al copular, recibieran el fluido seminal sin esperma y el estímulo mecánico, mientras que en Reyes-Hernández et al., (2021) se utilizaron inyecciones en el tórax de las hembras con los PGAs. La testectomía nos permite estudiar estas sustancias sin dañar a la hembra y teniendo una cópula normal con el macho.
Un resultado importante en este este trabajo fue determinar que las hembras vírgenes no solo ovipositan, sino que también marcan, no hubo diferencias entre los tratamientos en el tiempo que invierten marcando las hembras. Es decir, encontramos que las hembras vírgenes invirtieron el mismo tiempo marcando que las hembras que recibían o no un eyaculado, aunque Magalhães et al. (2022) reportó que para el caso de las hembras vírgenes de A. fraterculus no producen cantidades detectables de feromona.
Por lo contrario, la condición del macho sí afecta el comportamiento de marcaje, las hembras que copularon con machos silvestres marcaron más tiempo comparado con las hembras apareadas con machos irradiados, por lo que la condición del macho sí influye en la inversión maternal en la FMH. Sin embargo, no hubo diferencias significativas en el número de huevos que pusieron las hembras. Posiblemente las hembras pueden detectar la calidad del macho, los de mejor calidad serían los silvestres, existen varios estudios que han demostrado que las hembras prefieren aparearse con machos silvestres (Pérez-Staples et al., 2013). Una posibilidad es que las hembras realizan el marcaje por mayor tiempo después de copular con un macho silvestre porque reciben mayor número de espermatozoides, en comparación con las hembras que copularon con machos irradiados (Contreras-Navarro et al., 2020), por lo que las hembras harían mayor inversión maternal y depositan más FMH para defender el recurso para su progenie.
Se requieren más estudios para entender cómo es que la condición del macho afecta la inversión maternal de la hembra a través de la FMH.
Conclusiones
1. El estímulo mecánico de la cópula y el eyaculado incrementan la oviposición.
2. Las hembras vírgenes ovipositan menos huevos que las hembras apareadas, pero marcan el hospedero e invierten el mismo tiempo en marcar.
3. No se encontró que los PGAs tuvieran un efecto en el comportamiento de marcaje.
4. Las hembras apareadas con machos estériles ovipositan igual número de huevos que las hembras apareadas con machos silvestres, sin embargo, invierten menos tiempo depositando la FMH.
5. Se sugiere seguir estudiando la función de los PGAs y el efecto que pueda tener la condición del macho en la inversión de la hembra en la FMH.
Referencias
Abraham S., Lara-Pérez L. A., Rodríguez C., Contreras-Navarro, Y., Nuñez-Beverido, N., Ovruski, S., & Pérez-Staples, D. (2016). The male ejaculate as inhibitor of female remating in two tephritid flies. Journal of Insect Physiology, 88. 40—47.
Abraham S., Nuñez-Beverido N., Contreras-Navarro Y. & Pérez-Staples D. (2014). Female receptivity in Anastrepha ludens (Diptera: Tephritidae) is not modulated by male accessory gland products. Journal of Insect Physiology, 70. 41—48.
Allinghi A., Gramajo C., Willink E. & Vilardi J. (2007). Induction of sterility in Anastrepha fraterculus (Diptera: Tephritidae) by gamma radiation. Florida Entomologist, 90 (1). 96—102.
Aluja M. & Boller E. F. (1992). Host marking pheromone of Rhagoletis cerasi: field deployment of synthetic pheromone as a novel cherry fruit fly management strategy. Entomologia Experimentalis et Applicata, 65 (2). 141—147.
Aluja M. & Boller E. F. (1992). Host marking pheromone of Rhagoletis cerasi: Foraging behavior in response to synthetic pheromonal isomers. Journal of Chemical Ecology.18 (8). 1299—1311.
Aluja M. & Díaz-Fleischer F. (2006). Foraging behavior of Anastrepha ludens, A. obliqua, and A. serpentina in response to feces extracts containing host marking pheromone. Journal of Chemical Ecology, 32 (2). 367—389.
Aluja M. (1993). Manejo Integrado de la Mosca de la Fruta (Diptera: Tephritidae). Editorial Trillas, México. (No. SB608. F8 A47).
Aluja M., Díaz-Fleischer F., Boller E. F., Hurter J., Edmunds A. J. F., Hagmann L. & Reyes, J. (2009a). Application of feces extracts and synthetic analogues of the host marking pheromone of Anastrepha ludens significantly reduces fruit infestation by A. obliqua in tropical plum and mango backyard orchards. Journal of Economic Entomology, 102 (6). 2268—2278.
Aluja M., Piñero J., Jácome I., Diaz-Fleischer F. & Sivinski J. (2000). Behavior of flies in the genus Anastrepha (Trypetinae:Toxotrypanini). En Fruit Flies (Diptera:Tephritidae): Phylogeny and Evolution of Behavior. Pp. 375—406.
Aluja M., Rull J., Sivinski J., Trujillo G., & Pérez-Staples, D. (2009b). Male and female condition influence mating performance and sexual receptivity in two tropical fruit flies (Diptera: Tephritidae) with contrasting life histories. Journal of Insect Physiology. 55 (12). 1091—1098.
Arredondo J., Diaz-Fleischer F., & Pérez- Staples Diana. (2020). Biología y Comportamiento. En: Moscas de la Fruta: Fundamentos y Procedimientos para su Manejo. S y G editores. Pp 129—154.
Arredondo J., Tejeda M. T., Ruiz L., Meza J. S. & Pérez-Staples D. (2017). Timing of irradiation and male mating history effects on female remating in Anastrepha ludens (Diptera: Tephritidae). Florida Entomologist, 100 (3). 566—570.
Avila F.W., Sirot L.K., LaFlamme B.A., Rubinstein C.D. & Wolfner M. F. (2011). Insect seminal fluid proteins: identification and function. Annual Review of Entomology. 56 (1). 21—40.
Baena-Hurtado M. L. & Pérez-Staples D. (2015). La intimidad sexual de los insectos. En: La ciencia y el hombre. Universidad Veracruzana. 8—11.
Birke Biewendt A. B. (2006). Efecto de la calidad del hospedero en el comportamiento de oviposición de cuatro poblaciones de la mosca mexicana de la fruta: Anastrepha ludens (Loew), Diptera: Tephritidae. Tesis de XX poner la Facultad y la Universidad, la ciudad y el Pais. 9—27.
Contreras-Navarro Y., Pérez-Staples D., Orozco-Dávila D. & Díaz-Fleischer F. (2020). Pre and post-copulatory competitiveness of the genetic sexing strain Tapachula-7 of Anastrepha ludens (Diptera: Tephritidae). Journal of Economic Entomology, 113 (5). 2163—2170.
Córdova-García G., Esquivel C. J., Pérez-Staples D., Ruiz-May E., Herrera-Cruz M., Reyes-Hernández, M. & Sirot L. (2022). Characterization of reproductive proteins in the Mexican fruit fly points towards the evolution of novel functions. Proceedings of the Royal Society B, 289 (1977). 20212806.
Córdova-García G., Sirot L., Abraham S., Díaz-Fleischer F., Flores-Estevez N., López-Ortega M. & Pérez-Staples D. (2021). Mating, but not male accessory gland products, changes female response to olfactory cues in Anastrepha fruit flies. Frontiers in Physiology, 12. 714247.
Díaz‐Fleischer F. & Aluja M. (2003). Behavioural plasticity in relation to egg and time limitation: the case of two fly species in the genus Anastrepha (Diptera: Tephritidae). Oikos, 100 (1). 125—133.
Díaz‐Fleischer F. & Aluja M. (2003). Clutch size in frugivorous insects as a function of host firmness: the case of the tephritid fly Anastrepha ludens. Ecological Entomology, 28 (3). 268—277.
Díaz-Fleischer F., Papaj D. R., Prokopy R. J., Norrbom A. L. & Aluja M. (2000). Evolution of fruit by oviposition behavior, fruit bies(Tephritidae). Phylogeny and Evolution of Behavior. 811—841.
Flores S., Campos S., Gómez E., Espinoza E., Wilson W. & Montoya, P. (2015). Evaluation of field dispersal and survival capacity of the genetic sexing strain Tapachula-7 of Anastrepha ludens (Diptera: Tephritidae). Florida Entomologist, 98 (1). 209—214.
Gillott C. (2003). Male accessory gland secretions: modulators of female reproductive physiology and behavior. Annual Review of Entomology 48.163—184.
Hernández-Ortiz V. (2007). Diversidad y biogeografía del género Anastrepha en México. En: Moscas de la fruta en Latinoamérica (Diptera: Tephritidae): Diversidad, Biología y Manejo. S y G editores. Pp 53—76.
Hoffmeister T. S. & Roitberg B. D. (2008). Evolutionary ecology of oviposition marking pheromones. In: Chemoecology of insect eggs and egg deposition, eds. Hilker M. and Meiners T. Pp 319-344.
Liedo P., Toledo A. J. & Ruiz-Montoya L. (2009). Manejo evolutivo de plagas: Las moscas de la Fruta. Ciencia 60 (4). 62—70.
Meza-Hernández J. S. & Díaz-Fleischer F. (2006). Comparison of sexual compatibility between laboratory and wild mexican fruit flies under laboratory and field conditions. Journal of Economic Entomology, 99 (6). 1979—1986.
Papaj D. R. & Aluja M. (1993). Temporal dynamics of host-marking in the tropical tephritid fly, Anastrepha ludens. Physiological Entomology, 18 (3). 279—284.
Papaj D. R., Averill A. L., Prokopy R. J. & Wong T. T. (1992). Host-marking pheromone and use of previously established oviposition sites by the mediterranean fruit fly (Diptera: Tephritidae). Journal of Insect Behavior, 5 (5). 583—598.
Pérez-Staples D. (2010). Diversidad de comportamiento en moscas de la fruta. Revista Mexicana Biodiversidad 4. 1—7.
Pérez‐Staples D., Martínez‐Hernández M. G., & Aluja M. (2010). Male age and experience increases mating success but not female fitness in the Mexican fruit fly. Ethology, 116 (8). 778—786.
Pérez‐Staples D., Shelly T. E. & Yuval B. (2013). Female mating failure and the failure of ‘mating’ in sterile insect programs. Entomologia Experimentalis et Applicata, 146 (1). 66—78.
Prokopy R. J., Ziegler J. R. & Wong T. T. (1978). Deterrence of repeated oviposition by fruit-marking pheromone in Ceratitis capitata (Diptera: Tephritidae). Journal of Chemical Ecology, 4 (1). 55—63.
Reyes-Hernández M., Córdova-García G., Díaz-Fleischer F., Flores-Estévez N. & Pérez-Staples D. (2021). Oviposition after sex: mated Anastrepha ludens (Diptera: Tephritidae) females increase oviposition without receiving an ejaculate. The Canadian Entomologist, 153 (5). 524—537.
Reynolds O. L., Collins D., Dominiak B. C. & Osborne T. (2022). No sting in the tail for sterile bisex Queensland fruit fly (Bactrocera tryoni Froggatt) release programs. Insects, 13 (3). 269.
Roitberg B. D. & Prokopy R. J. (1983). Host deprivation influence on response of Rhagoletis pomonella to its oviposition deterring pheromone. Physiological Entomology, 8 (1). 69-72.
Scolari F., Gomulski L. M., Ribeiro J. M., Siciliano P., Meraldi A., Falchetto M. & Malacrida A. R. (2012). Transcriptional profiles of mating-responsive genes from testes and male accessory glands of the Mediterranean fruit fly, Ceratitis capitata. PLoS ONE, 7(10). 1—15.
Silva M. A., Bezerra-Silva G. C. D. & Mastrangelo T. (2012). The host marking pheromone application on the management of fruit flies a review. Brazilian Archives of Biology and Techonology, 55 (6). 835—842.
Wedell N. & Karlsson B. (2003). Paternal investment directly affects female reproductive effort in an insect. Proceedings of the Royal Society of London. Series B: Biological Sciences, 270 (1528). 2065—2071.
Wolfner M. F. (2002). The gifts that keep on giving: physiological functions and evolutionary dynamics of male seminal proteins in Drosophila. Heredity, 88 (2). 85—93.
Zapata S. D. (2022). Economic implications of the Mexican fruit fly infestation in Texas. The Journal of Extension, 60 (2): 3.
Anexos
Elaboración de esferas de agar (unidad de oviposición)
Para la oviposición de las hembras se utilizaron esferas de agar.
Ingredientes:
Agar bacteriológico: 28gr.
Agua: 1400 ml.
Colorante vegetal verde 5 gotas.
Para obtener 32 esferas de agar.
Procedimiento: se colocó el agua en un recipiente y se dejó a fuego lento, se le agregó el agar para que se hidratara y las gotas de colorante. Se retiró del fuego y se dejo enfriar un poco para poderlo vaciar en los moldes.